Patientenrekrutierung

- Gesundheit bei Bayer
-
Pharmaceuticals
- Therapiebereiche
- Innovation & Technologien
- Cell and Gene Therapy
-
Nachhaltigkeit
- Charta über den Patientenzugang
- Führungsperspektiven
- Stärkung des Zugangs zu Gesundheitsversorgung
- Verbesserung Umgang mit nicht übertragbaren Krankheiten
- Sicherstellung nachhaltiger Produktversorgung
- Delivering Better Cancer Care
-
Frauen weltweit stärken
- Boosting Family Planning Usage through Digital Channels
- Capacity building: Addressing Root Causes through Partnerships
- Impact at Scale: The Challenge Initiative
- Promoting Awareness: World Contraception Day (WCD) & the Your Life Campaign
- Providing Accessible and Affordable Contraceptives
- Enabling Family Planning in Humanitarian Settings
- Bekämpfung vernachlässigter Tropenkrankheiten
- Transparenz
- News & Stories
- Persönliche Gesundheit
- Eine Nebenwirkung melden
- Vorsicht Fälschung
Bayer richtet sich bei der Forschung am Menschen – insbesondere bei der Rekrutierung von Patienten – nach den strengsten wissenschaftlichen und ethischen Grundsätzen und bewegt sich dabei stets im Einklang mit gültigem Recht.
Bewusstsein für Vorteile und potenzielle Risiken
Jeder Patient muss sich über die möglichen Vorteile und Risiken der Teilnahme an einer klinischen Studie im Klaren sein.
Zusätzlich zum persönlichen Beitrag des Einzelnen zum medizinischen Fortschritt ist einer der wichtigsten Beweggründe für die Teilnahme an einer klinischen Studie zugleich auch der mögliche individuelle Nutzen: Die Patienten haben Zugang zu einer Behandlung, die am Markt noch nicht verfügbar ist – einer Behandlung, die den Verlauf ihrer Erkrankung abkürzen, ihr Leben verlängern oder ihre Lebensqualität verbessern kann.
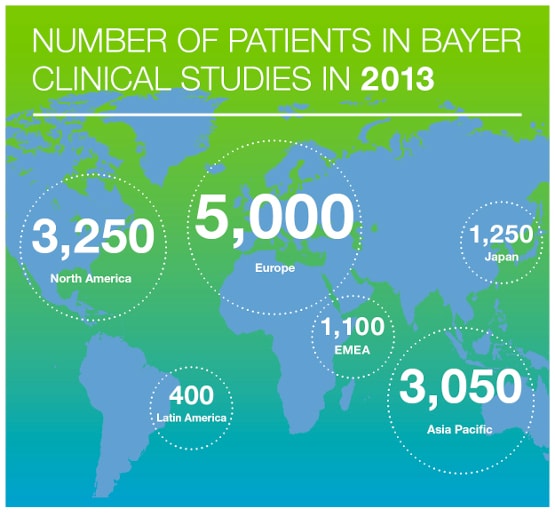
Ein mögliches Risiko der Teilnahme an einer klinischen Studie ist, dass die geprüften Medikamente weniger wirksam oder verträglich sein könnten als die bislang eingesetzte Standardtherapie. Darüber hinaus können neue Behandlungsformen auch mit unvorhersehbaren unerwünschten Wirkungen einhergehen.
Die Patienten werden darüber aufgeklärt, dass in den Phase-III-Studien ein neues Präparat mit der derzeitigen Standardbehandlung oder – sofern bislang keine Standardbehandlung existiert – mit einem pharmakologisch unwirksamen Placebo verglichen wird. Die Teilnehmer werden nach dem Zufallsprinzip, in der Regel per Computer, der Gruppe mit der Standardbehandlung oder der Gruppe für das Prüfpräparat zugewiesen. Diese Methode, auch Randomisierung genannt, hilft Verzerrungen zu vermeiden und stellt sicher, dass persönliche Entscheidungen oder andere Faktoren sich nicht auf die Ergebnisse der Studie auswirken.
Medizinischer Fortschritt und Innovation wären ohne diese Patienten nicht möglich. Mit ihrer Teilnahme leisten sie einen entscheidenden Beitrag dazu, dass für ein medizinisches Produkt – nach dem Nachweis seiner Sicherheit und Wirksamkeit – die behördliche Zulassung beantragt und es so auch für andere Patienten zugänglich gemacht werden kann.
Rechte und Verantwortlichkeiten von Studienteilnehmern
Durch die Entscheidung zur Teilnahme an einer klinischen Studie erhält der Patient weitreichende Rechte. Bevor eine klinische Studie beginnen kann, muss der betreuende Arzt die Patienten sowohl schriftlich als auch mündlich über alle wesentlichen Fakten und Einzelheiten der Studie aufklären. Die Patienten werden gebeten, ihre Bereitschaft zur Teilnahme durch Unterzeichnung einer Formulars zur informierten Einwilligung, auf Englisch „Informed Consent“ zu erklären. „Informed Consent“ ist ein stehender Begriff für die Zustimmung zur Teilnahmeeinwilligung nach ausführlicher Aufklärung. Der Patient erhält eine Kopie des Formulars, um jederzeit alles nachlesen zu können. Die „Informed Consent“-Formulare müssen vor der Ausgabe an den Patienten von der jeweiligen behördlichen Prüfungskommission, auch unabhängiges Ethikkomitee oder ethische Prüfungskommission genannt, freigegeben werden.

Da die Teilnahme an einer klinischen Studie völlig freiwillig ist, ist der Patient oder die Patientin frei in seiner oder ihrer Entscheidung, an der klinischen Studie teilzunehmen, und hat das Recht, sich jederzeit ohne Angabe von Gründen aus der Studie zurückzuziehen. Die Behandlung mit der Standardtherapie bleibt auch dann auf jeden Fall gewährleistet. Patienten müssen umgehend von den untersuchenden Ärzten informiert werden, falls sich während der Studie neue Informationen über Nutzen, Risiken oder unerwünschte Wirkungen der Studienmedikation ergeben. Das pharmazeutische Recht verlangt darüber hinaus, dass der Sponsor einer klinischen Studie einen Versicherungsschutz für alle teilnehmenden Patienten bereitstellt.
Damit wird sichergestellt, dass ein Schadenersatz geleistet werden kann, falls sich die Behandlung während oder nach der Studienteilnahme trotz aller vorbeugenden Maßnahmen nachteilig auf die Gesundheit eines Patienten auswirken sollte.
Zum Schutz der gesammelten personen- und studienbezogenen Teilnehmerdaten werden alle Daten während und nach der Studie verschlüsselt, so dass die Identität der Patienten vertraulich bleibt.
Mit der Entscheidung zur Teilnahme an einer klinischen Studie gehen Patienten allerdings auch bestimmte Verpflichtungen ein, wie die strikte Befolgung studienbezogener Abläufe. Dazu gehören Einnahmezeiten, Einhaltung von Kontrolluntersuchungen und die umgehende Information der untersuchenden Ärzte über unerwünschte Wirkungen. Darüber hinaus sollten Patienten ihren Hausarzt sowie ihre behandelnden Fachärzte über ihre Teilnahme an einer klinischen Studie in Kenntnis setzen.
Die „richtigen“ Patienten für klinische Studien
Ein wichtiges Ziel bei der Auswahl der Patienten ist es, dass die Studie die klinische Realität in der Bevölkerung abbildet. Aus diesem Grund werden bereits vor Beginn der Studie spezifische. Ein- und Ausschlusskriterien potenzieller Teilnehmer definiert. Diese Kriterien umfassen z. B. Alter und Geschlecht, diagnostische Daten, medizinische Vorgeschichte und den aktuellen Gesundheitszustand. Damit die Ergebnisse tatsächlich auf die Behandlung in der Studie und nicht auf andere Einflüsse zurückgeführt werden können, dürfen nur Personen an einer Studie teilnehmen, welche die entsprechenden Kriterien erfüllen.
Die Anwendung klar definierter Ein- und Ausschlusskriterien für die Teilnahme stellt sicher, dass Personen, die negative Auswirkungen von der Teilnahme an der Studie davontragen könnten, diesem Risiko gar nicht erst ausgesetzt werden. Obwohl dies für alle Patienten wichtig ist, gilt es natürlich besonders für schwangere Frauen, ihre Föten und künftigen Kinder. Um vermeidbare Schäden auszuschließen, die durch Medikamente im Entwicklungsstadium verursacht werden könnten, werden schwangere oder stillende Frauen deshalb manchmal von klinischen Studien ausgeschlossen.
Die Entwicklung von Produkten für die Verwendung in der Kinderheilkunde ist noch einmal ein besonderes Gebiet der klinischen Forschung.








